L'électrolyse
Le courant électrique a des effets chimiques : on observe des décompositions quand il traverse certains liquides appelés électrolytes et qui ne peuvent être que des acides, des bases ou des sels soit fondus, soit en dissolution, généralement dans l'eau.
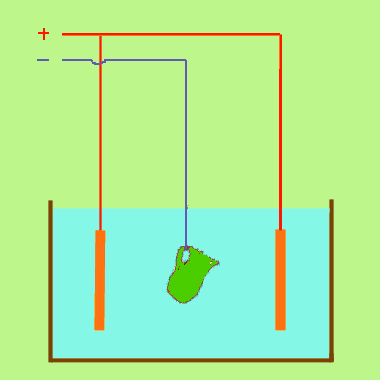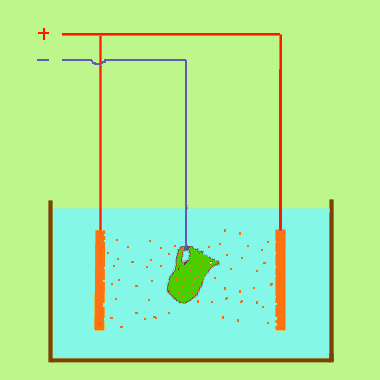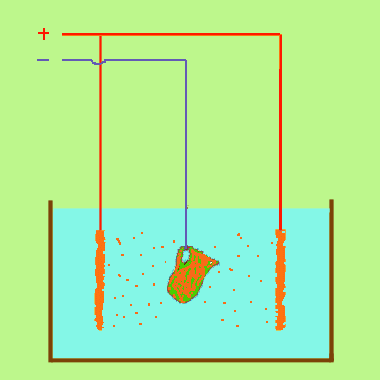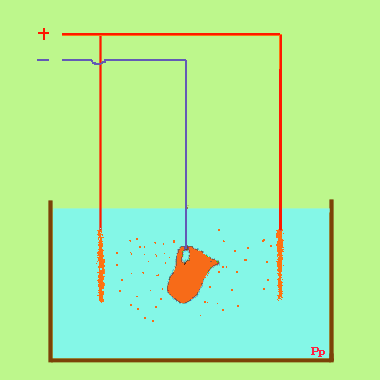
L'opération appelée électrolyte, se fait dans une cuve, la lame conductrice par laquelle arrive le courant est appelée l'électrode positive (borne d'entrée) ou anode, l'autre lame est l'électrode négative (borne de sortie) ou cathode.
Dans un solution de sulfate de cuivre CuSO4 avec une anode de cuivre et une cathode quelconque. (Voir exemple) Dans cet exemple, il se forme un dépôt de cuivre sur la cathode, mais rien ne se dégage sur l'anode. La coloration de la solution ne change pas : elle s'appauvrit donc pas en sulfate de cuivre , malgré le dépôt sur la cathode. Peu à peu l'anode disparaît. c'est qu l'ion SO4 après avoir perdu sa charge réagit sur le cuivre pour donner du sulfate qui se dissout, et l'on peut résumer ainsi :

Les applications de l'électrolyse sont nombreuses, on l'utilise pour la préparation industrielle d'un grand nombre de corps ( hydrogène, oxygène, chlore, soude, chlorate de potassium, aluminium, cuivre, etc...
Elle sert aussi à déposer une couche de métal (cuivre, nickel, chrome, argent, or) sur un objet quelconque servant de support, soit de moule. C'est la galvanoplastie. On peut ainsi préserver le fer de la rouille : il suffit de le nickeler. On peut recouvrir un corps d'un métal précieux par argenture ou par dorure électrolytique.
Le même phénomène permet de l'employer à l'affinage des métaux impurs, le cuivre par exemple.
Voir aussi : Calculette de la durée d'une opération d'électrolyse